Nichtkonformitäten sind Abweichungen von definierten Anforderungen. Diese Anforderungen können sich auf Normen (ISO 9001, Kundenspezifikationen), gesetzliche Vorgaben, interne Prozesse oder technische Produktspezifikationen beziehen.
Eine Nichtkonformität bedeutet, dass ein Prozess oder Produkt nicht das liefert, was erwartet oder gefordert wurde. Dazu gehören technische Fehler, Prozessabweichungen, Reklamationen, fehlende Prüfungen oder Verstöße gegen interne Standards. Sie entstehen während Entwicklung, Fertigung, Dienstleistungserbringung, Logistik oder beim Kunden.
Ursachen liegen meist in Prozessschwächen, fehlender Kommunikation, unzureichender Qualifikation, mangelnden Prüfungen, unklaren Anforderungen oder fehlerhaften Dokumenten. Durch Variation, menschliche Fehler, schwankende Eingangsqualitäten oder ungeeignete Prüfmethoden entstehen Abweichungen, die strukturell – nicht zufällig – bedingt sind.
Die ISO fordert daher, dass nicht nur der Fehler korrigiert wird, sondern auch die Gründe dafür vollständig verstanden werden.
Eine Korrektur behebt das unmittelbare Problem (z. B. Reparatur, Nacharbeit, Austausch). Eine Korrekturmaßnahme geht weiter: Sie beseitigt die Ursache des Fehlers – dauerhaft.
Ziel ist die nachhaltige Vermeidung weiterer Fehler. Nur dann ist eine Korrekturmaßnahme wirksam im Sinne der ISO 9001. Ohne Korrekturmaßnahme wird der Fehler wahrscheinlich wiederauftreten.
Die ISO 9001 verlangt die Bestimmung der Ursache. Techniken wie 5-Why, Ishikawa (Ursache-Wirkung), FMEA oder Fehlersammelkarten ermöglichen es, die wahren systemischen Ursachen zu identifizieren statt Symptome zu behandeln.
Eine Ursachenanalyse ist notwendig, um fundierte, wirtschaftlich realisierbare und technisch wirksame Maßnahmen festzulegen. Sie ist der zentrale Baustein des Verbesserungsprozesses.
Nach der Ursachenanalyse müssen konkrete Maßnahmen definiert werden. Dazu gehören: Verantwortliche festlegen, Termine definieren, Ressourcen bereitstellen, Risiken prüfen, gegebenenfalls Kunden informieren.
Die Maßnahmen können technischer, organisatorischer oder personeller Natur sein. Wichtig ist, dass sie auf die Ursache zielen und nicht nur Symptome beheben.
Die ISO 9001 fordert ausdrücklich eine Wirksamkeitsprüfung. Das bedeutet: Wurde der Fehler dauerhaft verhindert? Wurde der Prozess stabilisiert? Sind vergleichbare Probleme in ähnlichen Prozessen ausgeschlossen?
Ohne Wirksamkeitsprüfung ist der Prozess unvollständig. Viele Auditabweichungen entstehen genau hier: Maßnahmen wurden durchgeführt, aber ihre Wirkung wurde nicht bestätigt.
Ein einzelner Fehler kann ein Signal für ein systemisches Problem sein. Deshalb verlangt die ISO, zu prüfen, ob ähnliche Produkte, Baureihen oder Prozesse ebenfalls betroffen sein könnten. Ziel ist die Vermeidung von Serienfehlern oder breiteren Prozessschwächen.
Diese systemische Betrachtung schützt vor großflächigen Qualitätsproblemen und Reklamationen.
Jede Nichtkonformität beeinflusst das Risikoprofil des Unternehmens. Die ISO 9001 fordert deshalb, dass Risiken und Chancen nach einer Abweichung erneut geprüft, angepasst und bewertet werden.
Ein Fehler ohne Risikoaktualisierung ist unvollständig – denn der Fehler zeigt, dass das bestehende Risikomodell nicht vollständig war.
Korrekturmaßnahmen sollen sicherstellen, dass:
– Fehler systematisch erfasst werden
– Ursachen präzise identifiziert werden
– Fehlerkosten nachhaltig reduziert werden
– Kundenzufriedenheit signifikant steigt
– systemische Schwachstellen erkannt werden
– Risiken aktualisiert und reduziert werden
– das QMS weiterentwickelt wird
Ein Unternehmen steigert seine Qualität nachhaltig, wenn Fehler nicht als Problem, sondern als Verbesserungspotenzial gesehen werden.
Alle Schritte müssen dokumentiert werden, um nachzuweisen:
– was passiert ist
– welche Maßnahmen eingeleitet wurden
– wer entschieden hat
– welche Korrekturen durchgeführt wurden
– ob die Maßnahmen wirksam waren
Beispiele: Fehlerberichte, Prüfprotokolle, Maßnahmenpläne, Sonderfreigaben, Wirksamkeitsnachweise, Trendanalysen. Diese Dokumentation ist essenziell für Auditfähigkeit & Produkthaftung.
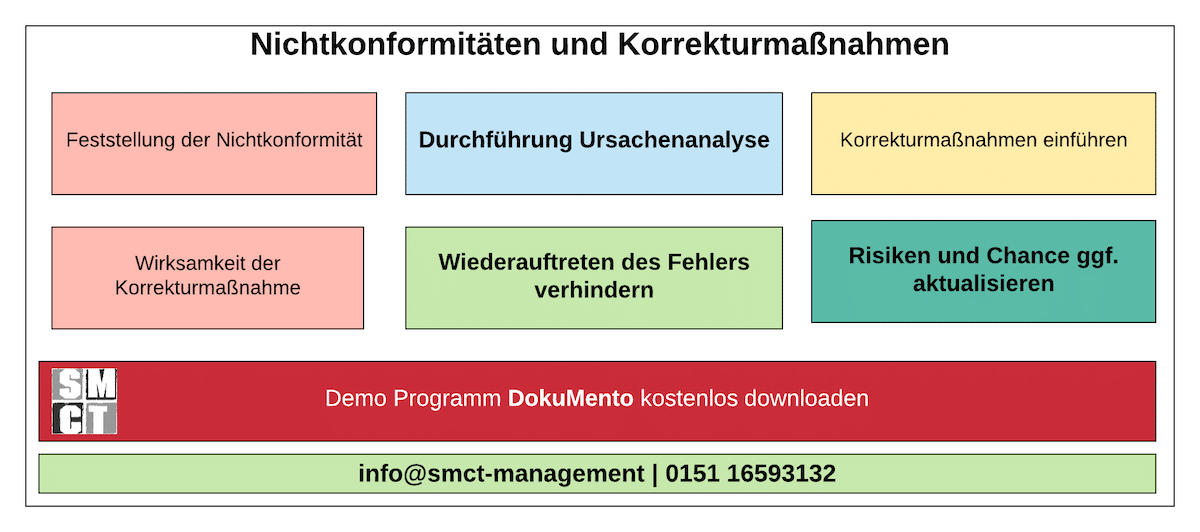
Nichtkonformität & Korrekturmaßnahmen im Audit
Der Umgang mit Nichtkonformitäten ist einer der kritischsten Punkte in ISO 9001-Audits. Auditoren wollen sehen, dass Fehler nicht nur „wegkorrigiert“, sondern systematisch analysiert und durch wirksame Korrekturmaßnahmen dauerhaft vermieden werden. Entscheidend ist der rote Faden: Fehler erkennen → Ursache verstehen → Maßnahme umsetzen → Wirksamkeit prüfen.
Die folgenden Bausteine zeigen, wie dieser Ablauf strukturiert gestaltet werden kann – als praxisnaher Leitfaden für Audits und für den Alltag im Qualitätsmanagement.
Grafik-Modell: Fehler → Ursache → Maßnahme → Wirksamkeit
Dieses Modell fasst den Kernprozess der Korrekturmaßnahmen zusammen. Es eignet sich ideal zur Visualisierung in Schulungen, Audits oder als Bestandteil des QM-Handbuchs.
Abweichung wird erkannt: durch Prüfungen, Audits, Reklamationen, Mitarbeiterhinweise oder Prozesskennzahlen. Die Nichtkonformität wird beschrieben, dokumentiert und – falls nötig – betroffene Produkte werden gesperrt.
Mit Methoden wie 5-Why, Ishikawa oder FMEA wird die tatsächliche Ursache identifiziert – nicht nur das Symptom. Ohne fundierte Ursachenanalyse besteht das Risiko, dass der Fehler in leicht veränderter Form wiederkehrt.
Aus der Ursache leiten wir gezielte Korrekturmaßnahmen ab: Prozessänderungen, Schulungen, technische Anpassungen, Prüfkonzepte, Lieferantenmaßnahmen usw. Verantwortliche, Fristen und Ressourcen werden festgelegt und die Maßnahmen nachverfolgbar dokumentiert.
Nach Umsetzung wird überprüft, ob der Fehler dauerhaft beseitigt ist: – treten ähnliche Fehler erneut auf? – sind Kennzahlen stabiler? – gibt es Rückmeldungen vom Kunden? Erst wenn dies bestätigt ist, gilt die Korrekturmaßnahme als wirksam abgeschlossen.
FAQ – Nichtkonformitäten & Auditfragen
Welche Fragen stellt der Auditor typischerweise zu Nichtkonformitäten?
Häufige Fragen sind z. B.: – Wie erfassen Sie Nichtkonformitäten? – Wie stellen Sie sicher, dass fehlerhafte Produkte nicht weiterverarbeitet oder ausgeliefert werden? – Können Sie mir ein Beispiel für eine Korrekturmaßnahme zeigen – mit Ursache und Wirksamkeitsnachweis? – Wie prüfen Sie, ob ähnliche Prozesse oder Produkte ebenfalls betroffen sind?
Wodurch entstehen im Audit oft Hauptabweichungen?
Hauptabweichungen entstehen häufig, wenn: – keine klare Kennzeichnung und Sperrung nichtkonformer Produkte vorhanden ist, – Fehler zwar korrigiert, aber Ursachen nicht analysiert wurden, – Maßnahmen zwar definiert, aber nicht wirksam sind, – Reklamationen wiederholt auftreten, ohne sichtbaren Lerneffekt. Kritisch ist vor allem, wenn fehlerhafte Produkte unbewusst beim Kunden landen können.
Welche Nachweise sollte ich im Audit bereithalten?
Empfehlenswert sind vollständige Beispiele: – Fehlerbericht / Reklamation – Sperrvermerk / Quarantänedaten – Protokoll der Ursachenanalyse (z. B. 5-Why, Ishikawa) – Maßnahmenplan mit Verantwortlichen und Terminen – Prüfprotokolle nach der Korrektur – Dokumentation der Wirksamkeitsprüfung So können Sie dem Auditor den gesamten Weg nachvollziehbar zeigen.
Wie reagiere ich, wenn der Auditor eine Schwachstelle aufdeckt?
Offenheit hilft mehr als Verteidigung. Zeigen Sie, wie Sie mit der Feststellung umgehen: Ursachenanalyse, Maßnahmenplanung, Fristen, Verantwortlichkeiten, Wirksamkeitsprüfung. Der Auditor bewertet weniger den Fehler als Ihren Umgang damit. Ein strukturiertes Vorgehen zeigt Reife des QM-Systems.
Wie oft sollten Korrekturmaßnahmen überprüft werden?
Mindestens einmal nach Umsetzung, idealerweise mit zeitlichem Abstand (z. B. nach einigen Wochen/Monaten). Wichtig ist, dass Sie Kennzahlen, Reklamationen und interne Fehlerquoten beobachten – und nachsteuern, wenn sich zeigt, dass Maßnahmen nicht ausreichend waren. In der Managementbewertung sollten wiederkehrende Themen kritisch betrachtet werden.
Korrekturmaßnahmen professionell etablieren
Sie möchten weg von „Feuerwehraktionen“ hin zu einem strukturierten, wirksamen Umgang mit Fehlern und Nichtkonformitäten? Wir unterstützen Sie beim Aufbau eines schlanken, auditfesten Prozesses – von der Sperrung über Ursachenanalyse bis zur Wirksamkeitsprüfung. Praxisnah, verständlich und auf Ihre Organisation zugeschnitten.
Jetzt unverbindlich anfragen
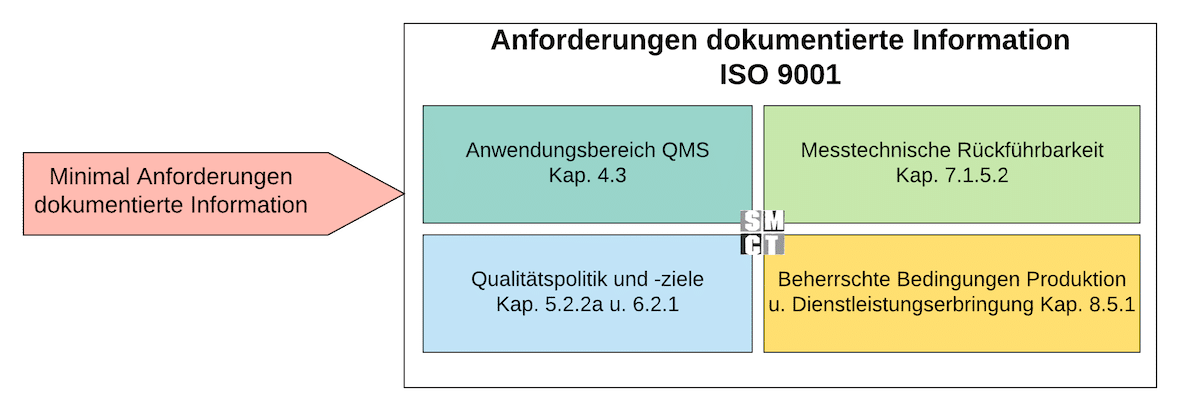
Anforderungen an dokumentierte Informationen (ISO 9001)
Dokumentierte Informationen sind ein zentrales Element der ISO 9001. Sie dienen dazu, die Funktionsfähigkeit des Qualitätsmanagementsystems sicherzustellen, Nachweise zu erbringen und Prozesse nachvollziehbar zu gestalten. Die Norm schreibt keine bestimmte Form vor – entscheidend ist, dass Informationen verfügbar, aktuell, gesteuert und nachweisbar sind.
Dokumentierte Informationen müssen belegen, dass Prozesse so ausgeführt wurden, wie es geplant und beschrieben ist. Dazu gehören z. B. Prüfberichte, Produktionsaufzeichnungen, Checklisten, Auditprotokolle, Schulungsnachweise oder Messdaten. Diese Nachweise zeigen: Der Prozess funktioniert, ist beherrscht und die Qualitätsanforderungen wurden eingehalten.
Dokumente müssen erstellt, geprüft, freigegeben, verteilt und versioniert werden. Es muss jederzeit klar erkennbar sein, welche Version gültig ist und wer die Freigabe erteilt hat. Veraltete Dokumente müssen entfernt oder eindeutig gekennzeichnet sein, um Fehlverwendung auszuschließen.
Aufzeichnungen (z. B. Prüfprotokolle, Messwerte, Reklamationsberichte) müssen lesbar, nachvollziehbar, manipulationssicher und langfristig verfügbar sein. Sie dienen als Nachweis und Grundlage für Entscheidungen, Analysen und Audits.
Mitarbeitende müssen jederzeit auf die für sie relevanten Informationen zugreifen können. Dokumente müssen also dort verfügbar sein, wo sie benötigt werden – digital oder physisch. Fehlende Verfügbarkeit führt häufig zu Prozessabweichungen oder Fehlern.
Dokumentierte Informationen müssen geschützt werden: vor Verlust, unbefugtem Zugriff, Manipulation oder Beschädigung. Dazu gehören Backups, Zugriffskonzepte, Archivierungsrichtlinien und technische Maßnahmen wie Rechtemanagement oder Verschlüsselung.
Dokumente müssen regelmäßig überprüft, aktualisiert und erneut freigegeben werden. Veraltete Formulare, alte Prüfpläne oder falsche Versionen führen zu Qualitätsproblemen. Die Organisation muss ein System zur periodischen Überprüfung vorhalten.
Dokumentierte Informationen müssen zeigen, wer etwas geprüft, freigegeben oder entschieden hat – und wann. Rückverfolgbarkeit ist besonders relevant bei Reklamationen, Risikoanalysen, Freigabeprozessen und Produkthaftungsthemen.
Im Fall von Fehlern oder Abweichungen muss die Dokumentation zeigen: Was war der Fehler? Welche Maßnahmen wurden ergriffen? Wer hat entschieden? Wurde die Wirksamkeit bestätigt? Ohne diese Nachweise gilt der Prozess als nicht normkonform.
Aufbewahrungsfristen müssen risikobasiert definiert und eingehalten werden. Dokumente müssen so archiviert werden, dass sie auch nach Jahren noch lesbar und abrufbar sind – besonders bei langfristigen Produkthaftungsfällen oder gesetzlichen Verpflichtungen.
Die ISO schreibt kein Format vor: Dokumente können digital, papierbasiert, als Videos, Fotos, Datenbanken oder in Cloud-Systemen geführt werden. Entscheidend ist allein die Wirksamkeit der Dokumentenlenkung und die Verfügbarkeit der gültigen Version.
Fazit: Dokumentierte Informationen sind nicht Bürokratie, sondern Grundlage der Prozesssicherheit, Nachvollziehbarkeit, Produkthaftung und Auditfähigkeit. Je klarer, aktueller und besser strukturiert die Dokumentation ist, desto wirksamer funktioniert das gesamte Qualitätsmanagementsystem.